El ion hidróxido[1][4] (OH-) puede obtenerse a partir de una concentración conocida de una concetración de hidronio y la ecuación Kw=[H+][OH-]. Esta ecuación se conoce como equilibrio del agua y se origina de la reacción ácido-base del agua, también conocida como autoionización del agua. Lo cual ocure por el siguiente proceso, como se ilustra:
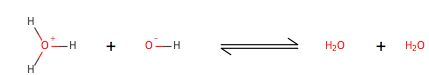
Dos moléculas de agua chocan, intercambian un protón, una partícula positivamente cargada, en este caso es un hidrógeno que falta un electrón. Una de las moléculas de agua actúa como un ácido y la otra actúa como una base. Existen tres teorías diferentes basadas en ácido. La teoría de Bronsted-Lowry sugiere que un ácido dona un protón a la base, la teoría de Lewis sugiere que una ácido acepta electrones de la base, y la teoría de Arrhenius sugiere que un ácido es cualquier molécula que aumenta la concentración de un hidrónio, conocidos como base conjugada (OH-) y ácido conjugado (H+). At 25oC la concentración de cada ión es 1.0x10-7 (mol/L), cuando ambas concentraciónes permancen iguales entonces la solución llega a ser nuetral.
Descripción
La ecuación es
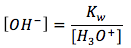 [2]
[2]
dónde
- [H3O+] es la concentración de iones hidronio en unidades de (mol/L)
- Kw es la constante de ionización del agua, que equivale a
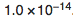 . [3]
. [3] - [OH-] es la concentración de iones hidróxido en unidades de (mol/L)
Temas Relacionados
- Concentración de iones de hidronio (para la pagina en inglés haga clic aquí)
- Calculadora de pH / pOH (para la pagina en inglés haga clic aquí)
Materiales Suplementarios
- Khan Academy: Autoionización del agua
Referencias
[1]https://es.wikipedia.org/wiki/Hidróxido
[2]Whitten, et al. 10th Edition. Pp.713
[3]https://es.wikipedia.org/wiki/Autoionización_del_agua
[4] Para la pagina en inglés haga clic aquí