La calculadora para La Ecuación de Balmer-Rydberg calcula la longitud de onda que corresponde a las diferencias de nivel de energía del átomo de hidrógeno cuando una corriente eléctrica pasa a través de gas hidrógeno a baja presión. Las diferencias entre los niveles de energía son iguales a la energía emetida o absorben como fotónes cuando un electrón transita de un nivel de energía más alto a un nivel de energía de cuántica inferior.
INSTRUCCIONES: Ingrese lo siguiente:
- (n1) representa el número entero del estado energético más alto para una emisión espectral.
- (n2) representa el número entero del estado energético más bajo para una emisión espectral (el estado energético de 1 es el más bajo).
λ: La calculadora devuelve la longitud de oda (λ) en las unidades de nanómetros (nm). Pero si necesitas convertir nanómetros en otras unidades (por ejemplo angstroms) usa el menú desplegable y la calculadora puede convertir las automáticamente.
La Fórmula
La ecuación de Balmer-Rydber es:
λ = 1 / [R ((1/n2) - (1/n'2))], donde:
- R representa el constante de Rydberg (1.097x 107 m-1)
- λ representa la longitud de onda
La fórmula calcula las longitudes de onda que corresponde a las diferencias del nivel de energía del átomo de hidrógeno cuando una corriente eléctrica pasa a través de gas hidrógeno a baja presión. Las diferencias entre los nivels de energía son iguales a la energía emitida o absorbida como fotónes cuando un electrón transita de un nivel de energía más alto a un nivel de energía cuántica inferior.
Descripción
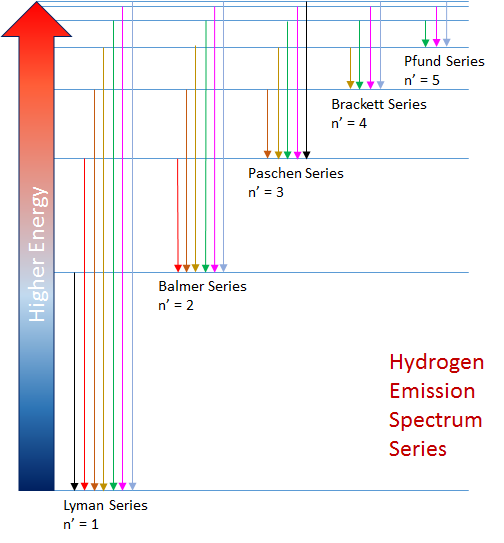
Cuando una corriente eléctrica pasa a través de gas hidrógeno (contenido en un tubo delgado) a a baja presión, se reproduce un resplandor rosado. Si esta luz es pasada a través de una rejilla, más colores resultarán y esto se considera ser el espectro de la emisión del hidrógeno. El espectro de emisión para las transiciones entre todos los niveles de energía inferior en culaquier transición, n', caracteriza las series espectrales. Los estados de energía, creados por las fuerzas electromagnéticas entre los electrónes y protónes en el átomo, son fijos. Esto asegura que el espectro de hidrógeno siembre se emite a las longitudes de onda precisas definidas por la ecuación de Rydberg. Los gráficos anteriores muestran los primeros cinco de un número infinito de series espectrales para el átomo de hidrógeno.
La ecuación de Balmer-Rydberg calcula la longitud de onda de una línea específica en el espectro de emisión de hidrógeno. En 1885, Balmer creó una ecuación para determinar la longitud de onda para las líneas en individuales en la serie Balmer, que Rydberg posteriormente generalizó para que pudiera ser usado para encontrar la longitud de onda de cualquiera de las líneas en el espectro de emisión de hidrógeno.
Más Información
UCDavis ChemWiki: Hydrogen's Atomic Emission Spectrum
Referencias Bibliográficas
Whitten, et al. "Chemistry" 10th Edition. Pp. 139