La ecuación para titulación III calcula el pH de la solución en punto de equivalencia, donde se titula un ácido débil con una base fuerte.
Ejemplo de como se puede resolver este tipo de problema:
Información que tienes: La concentración formal del ácido débil y la base fuerte, el volumen inicial del ácido débil, la cantidad de ácido débil que se añade Kw , Ka o pKa.
El punto de equivalencia es donde el ácido débil y la base fuerte son en equilibrio con el otro. Se puede ilustra esto con una gráfica de hielo (se llama ice table en inglés).
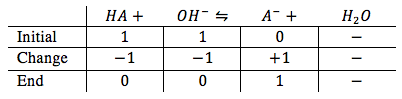
Porque el ácido débil y la base fuerte son en equilibrio, los dos producen un ácido fuerte. Nosotros podemos voltear la reacción y resolver para la concentración de ion hidróxido para encontrar el pH.
Primero nosotros necesitamos encontrar la concentración formal diluido del ácido débil porque ya se añade la base fuerte y se reacciona con el ácido.
Se puede calcular la concentración diluido con la ecuación
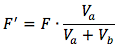
*Nota: para la descripción de las variables, desplazar hacia abajo.
Ahora, nosotros podemos usar esta nueva concentración formal para resolver la concentración de ión hidróxido como lo hicimos antes para la primera titulación.
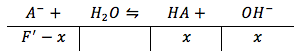
Pero, en este caso vamos a resolver para la concentración de ión hidróxido y no la concentración de ión hidronio. Entonces la ecuación para equilibrio va resolver para la base y necesitamos convertir Ka a Kb. Puedes hacer esto con la ecuación
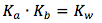
En By rearranging the variables we can solve for Kb, the equilibrium equation then becomes
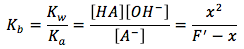
Ahora nosotros podemos resolver para x, la variable x representa lo mismo que la concentración de ion hidróxido, si nosotros multiplicamos Kb en F y tomamos la raíz cuadrada y conseguimos la ecuación
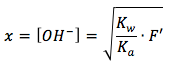
Nota que este se resolve para el ión de hidróxido y no el ión de hidronio, entonces no podemos introducir este valor en la ecuación de pH todavía. Primero, necesitamos convertir al ión de hidronio con esta ecuación y introducir el valor en la ecuación de pH.
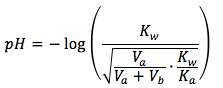
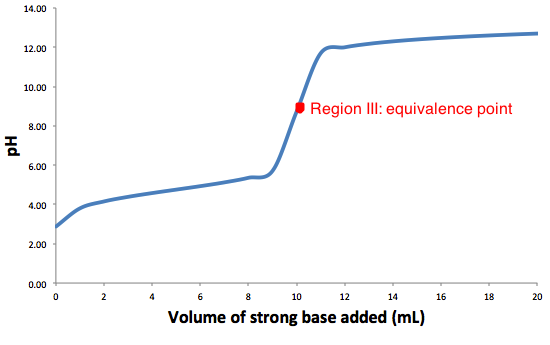
El gráfico arriba es la titulación típica de una reacción de ácido débil y base fuerte. El punto rojo representa el punto de equivalencia.
Descripción
La ecuación es
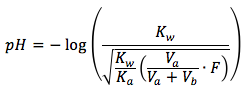
donde
- Kw representa el constante para la disociación de agua, Kw = 1.0x10-14
- Ka representa el constante para el equilibrio de ácido, is the acid equilibrium constant, can be found here.
- Va representa el volumen inicial de ácido débil en solución en las unidades de mililitro (mL)
- Vb representa el volumen de base fuerte que se añade en la solución en las unidades de mililitro (mL)
- F representa la concentración formal de ácido débil en las unidades de (mol/L)
Referencias Bibliográficas
Harris, 9th Edition. Pp.236-238