La elevación del punto de ebullición[1] es una ecuación de propiedad colligativa[3] que calcula la nueva temperatura de ebullición del disolvente después de haber sido mezclada con un soluto. La adición de solutos hace que el disolvente se impure, haciendo que el punto de ebullición se eleve. Sin embargo, para que el punto de ebullición del disolvente se eleve, el soluto no debe contribuir a la presión de vapor y debe permanecer en el disolvente durnte todo el cambio de fase. equation that calculates the new boiling temperature of the solvent after it has been mixed in with a solute. La impureza del disolvente causa una disminución en su potencial químico[6], que es la cantidad de energía libre de Gibbs molar[4],[5] un mol de disolvente contribuye a la mezcla. Un alto potencial químico impulsa la reacción hacia la formación del producto, sin embargo el aumento de la molaridad del soluto, aumenta el punto de ebullición y disminuye el potencial el potencial químico.
Descripción
La elevación del punto de ebullición puede calcularse mediante:
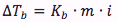
dónde:
- ΔTb es el cambio en la temperatura de ebullición del disolvente en unidades de (oC).
- Kb es el constante ebullioscópica, única para cada disolvente en unidades de (oC kg/mol), se puede encontrar una lista completa aquí.
- m es la molalidad del soluto en unidades de moles de soluto por kg de disolvente (mol/kg)
- i es el factor de van't Hoff[7] que toma la disociación del soluto en cuneta, para un soluto que no dissocie i = 1, para los solutos disociables el valor de i dependerá de cuenta partícula el soluto se disocia en, más información se puede encontrar aquí.
Temas Relacionados
- Depresión del Punto de Congelación (para el sitio en inglés haga clic aquí)
- Molalidad (para el sitio en inglés haga clic aquí)
- Energía Libre de Gibbs (para el sitio en inglés haga clic aquí)
Materiales Suplementarios
- Khan Academy:
- HyperPhysics :
Referencias
[1]https://es.wikipedia.org/wiki/Elevación_del_punto_de_ebullición
[2]Whitten, et al. 10th Edition. Pp.524
[3]http://hyperphysics.phy-astr.gsu.edu/hbasees/Chemical/collig.html
[4] https://es.wikipedia.org/wiki/Energ%C3%ADa_de_Gibbs
[5]http://hyperphysics.phy-astr.gsu.edu/hbasees/Chemical/gibbspon.html