Antes que se Añade una Base Fuerte a un ácido débil
Tags | |
UUID | 3edb514c-6423-11e7-9770-bc764e2038f2 |
La ecuación para titulación I calcula el pH de la solución antes que se añade una base fuerte a un ácido débil.
Ejemplo de como se puede resolver este tipo de problema:
Información que sabes: la concentración formal del ácido débil y la base fuerte, Ka o pKa.
Porque todavía no se añade una base fuerte, la solución solamente tiene agua y el ácido débil. Entonces podemos tratar este tipo de problema como un problema del equilibrio para ácido y resolver para la concentración de ion de hidronio para encontrar el pH.
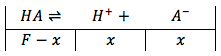
depués la ecuación de equilibrio es the equilibrium equation is then
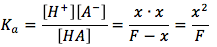
* Nota: nosotros podemos ignorar el x en el denominador, porque F>>x, nosotros podemos suponer que la concentración de hidronio no va tener un efecto significativo en la concentración formal.
Después nosotros multiplicamos los dos lados en F y tomamos la raíz cuadrada y conseguimos la ecuación
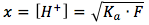
depués nosotros podemos introducir este en la ecuación de pH y depués la ecuación final es
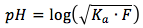
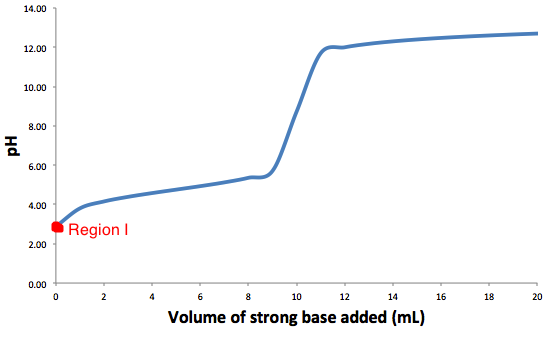
Este es el gráfico típico para una titulación de un ácido débil con una base fuerte.
Descripción
La ecuación es
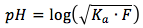
donde
- Ka representa el constante para el equilibrio de ácido, puedes encontrar los constantes para todos los ácidos aquí.
- F representa la concentración formal del ácido débil en las unidades de (mol/L)
Referencias Bibliográficas
Harris, 9th Edition. Pp.236-238
- Comments
- Attachments
- Stats
No comments |
