El ion hidrónico[1] (H3O+, también conocido como H+) y el ión de hidróxido[2] (OH-) se pueden obtener a partir de una concentración conocida del otro ion y la ecuación Kw=[H+][OH-]. Esta ecuación es conocido como el equilibrio de agua y se origina de la reacción ácido-base de agua, también conocido como autoionización de agua. Lo cual ocurre por el siguiente proceso, como se ilustra:
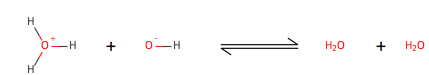
Cuando dos moléculas de agua chocan, intercambian un protón, una partícula positivamente cargada, en este caso es hidrógeno le falta un electrón. Uno de las moléculas de agua actúa como un ácido y la otra actúa como una base. Existen tres diferentes teorías basadas en ácido. La teoría de Bronsted-Lowery sugiere que un ácido dona un protón a la base, la teoría de Lewis sugiere que un ácido acepta electrónes de la base, y la teoría de Arrhenius sugiere que un ácido es cualquier molécula que aumenta la concentración de hidronio en agua y una base aumenta la concentración de un hidróxido. Puesto que la teoría de Arrhenius autoioniza el agua no explica la formación de los iones de hidronio o hidróxido conocidos como base conjugada (OH-) y ácido conjugado (H+). En 25°C la concentración de cada ión es 1.0x10-7 (mol/L), cuando ambas concentraciónes permanecen iguales, entonces la solución se convierte en neutral.
pH[3] es la medida de la acidez de una solución. La medida del pH es deriva de la medida de la concentración de ión hidronio. pOH[4] es una medida de la basicidad de una solución y su medición se deriva de la concentración de ión de hidróxido. Las concentraciónes de iones son pequeñas en la solución de pH y pOH, y luego comparadas con una escala. La escala de pH oscila entre 0 a 14, 0 siendo ácido y 14 siendo básico.
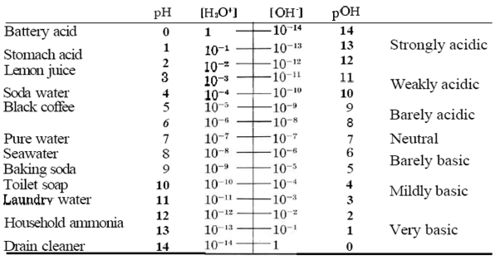
pKw[5] es el logaritmo (log) negativo de Kw, que es el equilibrio del agua. El equilibrio del agua es la multiplicación del ion de hidronio (H+) y el ion de hidróxido (OH-), igual a 1.0x10-14. El (log) negativo de Kw es 14, que es también el total de pH y pOH.
Calculadoras Para Encontrar pH y pOH
- Calculadora para encontrar pH de [OH-]
- Calculadora para encontrar pH de [H+]
- Calculadora para encontrar pH con pOH y pKw
- Calculadora para encontrar pOH de [OH-]
- Calculadora para encontrar pOH de [H+]
- Calculadora para encontrar pOH con pH y pKw
Más Información
- Khan Academy:
- CrashCourse:
- HyperPhysics:
- ChemWiki
Referencias Bibliográficas
[1]https://es.wikipedia.org/wiki/Ion_hidronio
[2]https://es.wikipedia.org/wiki/Hidróxido
[3]https://es.wikipedia.org/wiki/PH
[4]https://es.wikipedia.org/wiki/POH
[5]https://es.wikipedia.org/wiki/Autoionización_del_agua
[pH scale diagram]http://wiki.chemprime.chemeddl.org/index.php/PH_and_pOH_in_Everyday_Life
SaveSaveSaveSave