La Ecuacion de Van't Hoff
Tags | |
UUID | 523dc5ce-49ff-11e7-9770-bc764e2038f2 |
La Ecuación de Van't Hoff, ln(K2/K1) = ΔH0/R (1/T1 - 1/T2), proporciona información sobre la dependencia de la temperatura de la el constante de equilibrio. Esta ecuación fue propuesta en el año 1884 por Jacobus Henricus van't Hoff. Van't Hoff hizo grandes contribuciónes a la química física, específicamente en la cinética química, la estereoquímica, y el equilibrio químico.
INSTRUCCIONES: Elija sus unidades preferidas e ingrese lo siguiente:
- K1 representa el constante de equilibrio en temperatura absoluta T1.
- K2 representa el constante de equilibrio en temperatura absoluta T2.
- T1 es la temperatura absoluta.
- T2 es la segunda temperatura absoluta.
ΔH0: La calculadora devuelve la entalpía de reacción (el calor estándar de la reacción). Esta calculadora utiliza el constante de gas, Constante de Gas Ideal (R):8.3144626181532 J/(mol·K).
Todas las temperaturas se convierten automáticamente a Kelvin.
La Matemáticas
La fórmula en esta ecuación es la siguiente:
ΔH0=R⋅-ln(K2K1)1T1-1T2
Es una forma de: ln(K2/K1) = ΔH0/R (1/T1 - 1/T2) solved for ΔH0.
Descripción
Si se conocen los constantes de equilibrio para dos temperaturas diferentes, entonces se puede encontrar ΔH0 de una sustancia. Asimismo, si se conoce un constante de equilibrio (K1) para T1 y ΔH0, entonces se puede calcular la constante de equilibrio (K2) para una segunda temperatura. La ecuación de Van't Hoff supone que ΔH0 no cambia con la temperatura. Esto no es necesariamente cierto; ΔH0 cambia con la temperatura, pero el cambio es lo suficientemente pequeño como para que se considere insignificante al estimar K2.
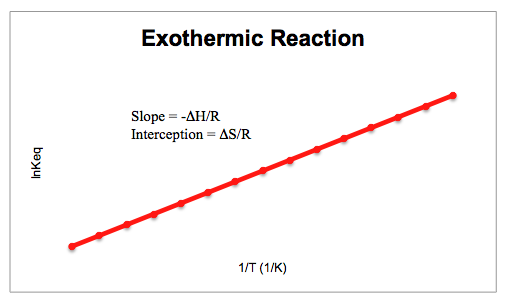
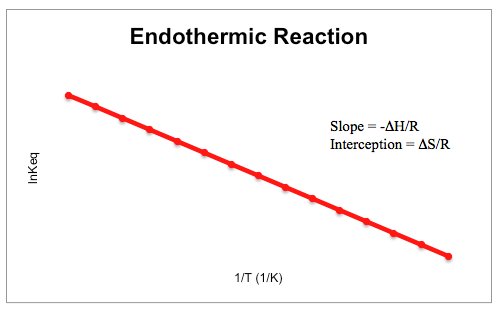
Cuando el constante de equilibrio y la temperatura se trazan entre sí, tanto una reacción exotérmica como una reacción endotérmica tendrán una forma característica en su gráfica. Los gráficos exotérmicos tienden a ser lineales con una pendiente positiva, mientras que las reacciones endotérmica son lineales con una pendiente negativa, como se muestra a continuación.
Temas relacionados
Ecuación de Arrhenius (para encontrar k)
Clausius-Clapeyron Equation
Referencias Bibliográficas
Whitten, et al. "Chemistry" 10th Edition. Pp. 699
Equations and Data Items
- Comments
- Attachments
- Stats
No comments |
