La Ley de Velocidad de Primero Orden
Tags | |
UUID | 9c1b94d8-5688-11e7-9770-bc764e2038f2 |
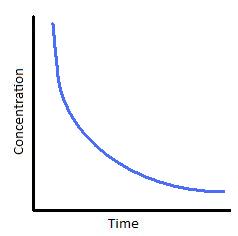 La ecuación para la ley de velocidad primero orden calcula la velocidad en que los productos se convertir a reactivos, como la velocidad depende en una concentración de solamente uno reactivo. La ecuación arriba es la forma diferencial[3] de la ecuación primero orden, que describe la velocidad en un nivel molecular y muestra como la velocidad depende en la concentración de los reactivos. Recuerdas que la velocidad en una forma diferencial es d/dt y se puede integrar. Puedes encontrar una integración completo de la ley de velocidad primero orden en inglés aquí.
La ecuación para la ley de velocidad primero orden calcula la velocidad en que los productos se convertir a reactivos, como la velocidad depende en una concentración de solamente uno reactivo. La ecuación arriba es la forma diferencial[3] de la ecuación primero orden, que describe la velocidad en un nivel molecular y muestra como la velocidad depende en la concentración de los reactivos. Recuerdas que la velocidad en una forma diferencial es d/dt y se puede integrar. Puedes encontrar una integración completo de la ley de velocidad primero orden en inglés aquí.
Descripción
La ecuación es
Rate=k[A]1=k[A] [2]
donde
- Rate representa la velocidad de la reacción primero orden en las unidades de (Molaridad/tiempo)
- k representa la constante de velocidad de la reacción en las unidades de (1/tiempo)
- [A] representa la concentración de los reactivos en las unidades de (mol/Litro)
Temas Relacionado
Más Información
- Khan Academy: Rate law and reaction order
- Rate and Order of Reactions
Referencias Bibliográficas
[1]https://en.wikipedia.org/wiki/Rate_equation
[2]Whitten, et al. 10th Edition. Pp. 626,629,631
[3]https://en.wikipedia.org/wiki/Differential_equation
[Picture] http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Kinetics/Reaction_Rates/First-Order_Reactions
Calculators
- Comments
- Attachments
- Stats
No comments |
