Ley de Velocidad de Segundo-Orden (forma diferencial)
Tags | |
UUID | 2b1a3c90-514b-11e7-9770-bc764e2038f2 |
La ecuación de La Ley de Velocidad de Segundo-Orden[1] calcula la velocidad que los reactivos se convierte en productos. La forma diferencial de la ley de velocidad segundo-orden es dependiente en los dos reactivos y así tiene dos diferente casos.
Caso 1. Los dos reactivos (A) son lo mismo
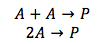 Porque los dos reactivos son lo mismo, la concentración de A se doble, este cuádruple la velocidad de la reacción. La ecuación de velocidad se convierte como se muestra abajo, donde la concentración de sustancia A se eleva a la segunda potencia. La velocidad de la reacción es solamente dependiente en la concentración de sustancia A.
Porque los dos reactivos son lo mismo, la concentración de A se doble, este cuádruple la velocidad de la reacción. La ecuación de velocidad se convierte como se muestra abajo, donde la concentración de sustancia A se eleva a la segunda potencia. La velocidad de la reacción es solamente dependiente en la concentración de sustancia A.
Caso 2. Los dos reactivos son diferente
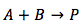
Los reactivos son diferente y la ecuación se convierte a
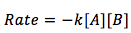
Cuando los dos reactivos se elevan al poder de uno. La velocidad de la reacción es dependiente en las concentraciónes de sustancias A y B.
Descripción
La ecuación es
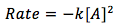 [2]
[2]
donde
- [A] representa la concentración de sustancia A en las unidades de (mol/L)
- k representa la constante de la ley de velocidad en las unidades de (L/mol*sec)
Otras Calculadoras
Más Información
- Khan Academy: Rate law and reaction order
Referencias Bibliográficas
[1]https://en.wikipedia.org/wiki/Rate_equation
[2]Whitten, et al. 10th Edition. Pp. 626,629,631
[Picture]http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Kinetics/Reaction_Rates/Second-Order_Reactions
- Comments
- Attachments
- Stats
No comments |
