Media Vida (Segundo Orden)
Tags | |
UUID | 76ee9fca-56a8-11e7-9770-bc764e2038f2 |
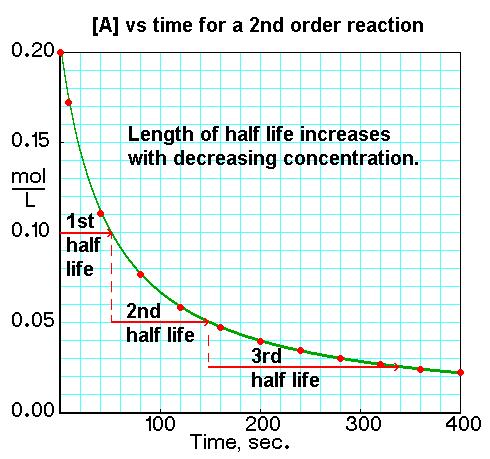
La media vida de una reacción química se define como el tiempo necesario para mitad de la cantidad de un reactivo se convertir en producto. Para encontrar las media vidas de diferente ordenes de reacciónes, nosotros usamos las leyes de velocidad integral y las constantes de velocidad para relacionar concentración a tiempo. Hay tres diferente leyes de velocidad que se pueden usar para encontrar la media vida de una reacción química: orden cero, primero orden, y segundo orden.
Reacciónes segundo orden son dependiente de concentración, igual que reacciónes primero orden; pero, reacciónes segundo orden reaccionan más rápido que reacciónes primero orden. La velocidad para reacciónes segundo orden es rate = k[A]2, así que la velocidad disminuye exponencialmente, a diferencia de reacciónes primero orden. La ley de velocidad es 1/[A] = kt + 1/[A]0 y la ecuación que se usa para encontrar la media vida de una reacción segundo orden es t1/2 = 1 / k[A]0.
Donde
- k representa la temperatura-dependiente constante de la velocidad de reacción
- t1/2 representa la media vida
- [A]0 representa la concentración inicial
Referencias Bibliográficas
Whitten, et al. "Chemistry" 10th Edition. Pp. 629
Mira También
Calculators
- Comments
- Attachments
- Stats
No comments |